Die pharmazeutische Industrie unterliegt strengen Auflagen und Richtlinien in der Entwicklung und Herstellung von Arzneimitteln. Zu den Anforderungen an ein ausführlich dokumentiertes und gelebtes Qualitätsmanagementsystem, das es nach den Good Manufacturing Practices (GMP) einzuhalten gilt, zählt auch die nahtlose Verfolgung von Änderungen in diesem Umfeld. Gemeinsam mit Daiichi Sankyo Europe GmbH hat TIMETOACT (ehemals edcom) eine Change Control Management Lösung auf Basis von Lotus Notes entwickelt, um Änderungsverfahren im GMP-Umfeld elektronisch abzubilden. Die Anwendung, die auch als Standardlösung verfügbar ist, ist bei allen GMP-Bereichen inklusive der Regulatory Affairs in der europäischen Zentrale der Daiichi Sankyo Europe GmbH im Einsatz.
Vertrauen ist gut, Kontrolle ist besser! Kontrolle kann geradezu lebenswichtig werden, wenn es sich um die Verfolgung von Änderungen – z.B. in Arzneimittelrezepturen – handelt. Aus diesem Grunde erwarten die für die pharmazeutische Industrie international festgelegten Standards der Good Manufacturing Practices (GMP), dass Änderungen in der Entwicklung, Herstellung und Prüfung von Arzneimitteln nach einem wohl organisierten und lückenlos dokumentierten System beantragt, bewertet, genehmigt und umgesetzt werden. Dies umfasst u. a. Änderungen an Rohstoffen, Herstellungsprozessen, Prüfmethoden, Anlagen und Einrichtungen (inklusive IT-Hard- und Software), Versorgungssystemen, Reinigungsverfahren, Lieferanten, Auftragsunternehmen und nicht zuletzt alle damit verbundenen Dokumentations- und Zulassungsaktivitäten.

Vom Gemeinschaftsprojekt zur Standardlösung
Was zunächst als Gemeinschaftsprojekt entstand, um die aus Validierung und Dokumentation einer geeigneten Software entstehenden Kosten zu verteilen und die Kompetenz zweier Experten zusammenzuführen, wird inzwischen auch als Standardlösung für andere Unternehmen angeboten.
In die Lösung CCM ist in allen Phasen der Entwicklung die umfassende Erfahrung von Daiichi Sankyo Europe GmbH als Spezialist für die Bedürfnisse der Pharmaindustrie sowie von TIMETOACT (ehemals edcom)als Softwareentwickler mit langjähriger Erfahrung in den Bereichen Konzeption und Umsetzung pharmazeutischer Anwendungen eingeflossen.
Von der Spezifikation bis zur Implementierung wurde dieses Projekt nach den in der Pharmaindustrie gültigen Richtlinien durchgeführt, validiert und entsprechend dokumentiert.
Regelwerke für den Einsatz computergestützter Systeme in der pharmazeutischen Industrie
Die rechtliche Grundlage zum Einsatz computergestützter Systeme stellt für in der EU ansässige pharmazeutische Unternehmen der Annex 11 zum EU-GMP-Leitfaden dar. Darüber hinaus müssen Firmen, die Arzneimittel nach USA exportieren wollen, auch die US-amerikanischen Vorgaben des 21 CFR Part 11 berücksichtigen, die sich speziell mit “electronic records” und “electronic signatures” beschäftigen. Als “Stand der Technik” werden die GAMP-Regeln (GAMP – Good Automated Manufacturing Practice) international anerkannt. Die grundsätzliche Anforderung an eingesetzte elektronische Systeme lautet, dass diese mindestens denselben Grad an Sicherheit und Zuverlässigkeit erfüllen müssen, wie dies für die nicht elektronischen Systeme in den GMP-Regelungen allgemein festgelegt ist.
Aufgabenstellung
Die europäische Tochtergesellschaft der Daiichi Sankyo Co., Ltd, eines der größten japanischen, international operierenden Pharmaunternehmen, stand vor der Aufgabe, ″von einem dezentralen papiergeführten auf ein zentrales, weitgehend papierloses System” umzustellen, beschreibt Dr. Rupert Straßer, Leiter der Abteilung Quality Management bei der Daiichi Sankyo Europe GmbH, die Ausgangslage. Bei dem gesuchten Lösungspartner musste gewährleistet sein, dass dieser über ein sehr großes Verständnis für GMP-Belange im IT-Umfeld verfügte und dass er in der Lage war, die daraus resultierenden hohen Anforderungen an die Softwareentwicklung und -validierung zu erfüllen.
Der Lösungspartner TIMETOACT (ehemals edcom) unterstützt die Daiichi Sankyo Europe GmbH bereits seit vielen Jahren in der SOP-Dokumentation (SOP – Standard Operating Procedure) auf der Basis von Lotus Notes, mit Domino Consulting im Infrastrukturbereich, mit Schulungen und im IBM-Lizenzmanagement. Auch der TIMETOACT (ehemals edcom) teamCalendar ist mit fast 300 Usern bei Daiichi Sankyo Europe GmbH im Einsatz.
Als Aufgabe für das gemeinsame Projekt “Change Control Management” (CCM) wurde die “Entwicklung einer Lotus Notes Datenbank mit hinterlegtem Workflow unter Einsatz elektronischer Unterschrift im Rahmen von Genehmigungsverfahren” spezifiziert.
Das Projekt inklusive Spezifikation, Programmierung, Prototyping, Validierung und Schulungsphase ist zwischenzeitlich erfolgreich abgeschlossen. Die Anwendung CCM ist bei allen Mitarbeitern in den GMP-Bereichen inklusive der Regulatory Affairs (RA) im produktiven Einsatz. Als “gelungene Entwicklung”, bestätigt Dr. Rupert Straßer seinen Projektnutzen bei der Abnahme der Datenbank. Für ihn war sowohl die “angenehme Zusammenarbeit” als auch das “ungewöhnlich hohe und positive Verständnis für die aus den GxP-Regularien resultierenden Anforderungen an Softwareentwicklung, -testung und Dokumentation im pharmazeutischen Umfeld” der beteiligten edcom Entwickler für den Projekterfolg mit entscheidend.
Prinzipeller Ablauf der Änderungskontrolle
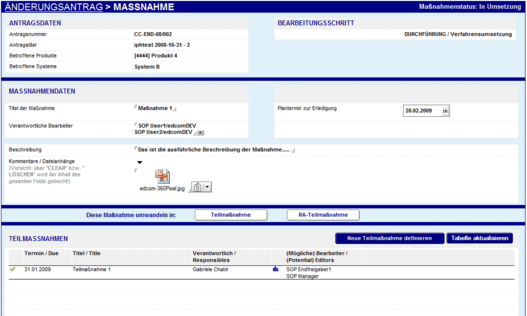
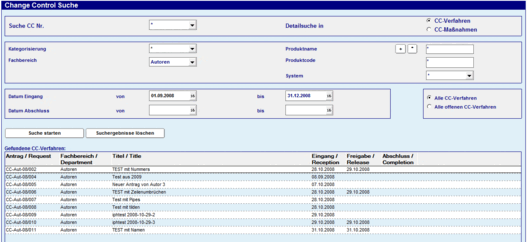
Mit der Change Control Management Lösung sind Anwender in der Lage, Änderungen zu beantragen und durchgeführte Maßnahmen und dazugehörige Informationen und Ergebnisse aufzuzeichnen, zu überprüfen und zu bestätigen.
Mit TIMETOACT (ehemals edcom) Change Control Management auf Basis von Lotus Notes sind die berechtigten Benutzer in der Lage,
- Änderungsanträge unter Angabe entsprechender Detailinformationen zu erstellen,
- den Änderungsanträgen erforderliche Umsetzungsmaßnahmen zuzuordnen und diese selektiv zu bearbeiten und
- sämtliche mit dem Antrag in Verbindung stehende Aktionen transparent und termingerecht zu verwalten und zu dokumentieren.
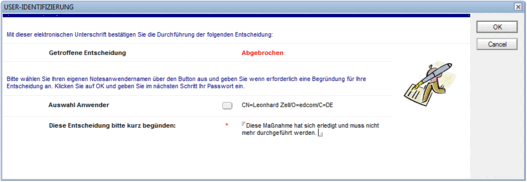
Jeder Bearbeitungsschritt, der üblicherweise mit einer elektronischen Unterschrift (Lotus-Notes-User-ID & Passwort) abgeschlossen wird, ist mit selektiven Rechten und Pflichten verbunden, über die auch mit standardisierten und in den jeweiligen Vorgang hinein verlinkten E-Mailbenachrichtigungen automatisch informiert wird.
Der Antrag durchläuft nach seiner Erstellung und Annahme durch den QM-Beauftragten zunächst einen Begutachtungs- und Genehmigungsprozess, bevor es zur tatsächlichen Umsetzung der einzelnen Maßnahmen des Verfahrens kommt. Maßnahmen können ferner in unterschiedliche Teilmaßnahmen unterteilt werden, denen jeweils wieder verantwortliche Bearbeiter sowie vorgesehene Erledigungstermine zuzuordnen sind. Eine Besonderheit stellt die mögliche Abbildung erforderlicher Zulassungsaktionen dar, für die eine spezielle “RA-(Regulatory Affairs) Maßnahmenmaske” entwickelt wurde.
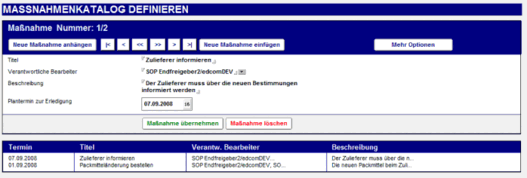
Für jeden Antrag kann der Anwender einen neuen Maßnahmenkatalog definieren.
Die verantwortlichen Bearbeiter innerhalb des Verfahrens erhalten bei Überschreitung von Planterminen per E-Mail eine Erinnerung zur Erledigung ihrer Aufgaben. Darüber hinaus ist eine Importfunktion verfügbar, mit der E-Mails aus dem Mailfile des Anwenders in den einzelnen Verfahren zur Dokumentation des laufenden Schriftverkehrs abgelegt werden können. Außerdem lassen sich direkt aus der Anwendung heraus neue Mails, automatisch verlinkt zum jeweiligen Dokument, generieren, verschicken und ablegen.
Weitere Features von CCM
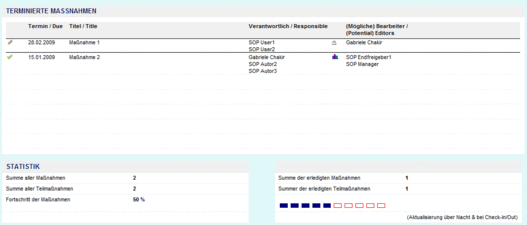
Über die Statistikanzeige im Antrag erfasst der Anwender den aktuellen Stand der Bearbeitung.
- Deutsche und englische Bedienoberfläche
- Check-In / Check-Out zur Verhinderung der gleichzeitigen Bearbeitung durch mehrere Anwender
- Direkte Verwaltung von Fachbereichen, ihnen zugeordneten Mitarbeitern sowie zugeordneten QM-Verantwortlichen in der Anwendung
- Elektronische Unterschriften für alle relevanten Aktionen und Entscheidung entsprechend der 21 CFR, Part 11 der US-amerikanischen FDA-Anforderungen
- Audit Trail mit Protokollierung aller wesentlichen Aktionen
- Über die Konfiguration individuell zu bestimmende Auswahllisten und Mailtexte
- Eindeutige Zuordnung einer Verfahrensnummer zu jedem Änderungsantrag
- Nicht mehr veränderbare Kopien von Änderungsanträgen werden nach Antragsstellung und nach vollständiger Genehmigung von Anträgen in einer separaten Audit-Trail-Datenbank zur Rückverfolgung möglicher Änderungen im Laufe des Verfahrens gespeichert.
Weiterentwicklung
Die Zusammenarbeit mit Daiichi Sankyo Europe GmbH wird auch in Zukunft fortgeführt. Im produktiven Einsatz einer Software werden sich immer wieder Änderungs- und Erweiterungswünsche seitens der Anwender ergeben. Diese werden von TIMETOACT (ehemals edcom) aufgenommen und in Folgeversionen des Standardprodukts einfließen.
Abnahme bei Daiichi Sankyo Europe GmbH

Die Datenbank gilt somit als abgenommen. Ich bedanke mich und beglückwünsche edcom zu dieser gelungenen Entwicklung, hoffe auf einen erfolgreichen Betrieb und eine weiterhin so angenehme Zusammenarbeit.
Dr. Rupert StraßerVice DirectorDaiichi Sankyo Europe GmbH

